مقدمة تعريفية:
هو عبارة عن سائل زيتي كثيف عديم اللون، يتميز بأنه حارق وآكل جداً.
صيغتة الجزيئية: H2SO4 .
لهذا الحمض اسماء عديدة مختلفة ولكن بالطبع فإن اشهر هذه المسميات هو "حامض الكبريتيك" ومن المسميات الاخرى التي تطلق عليه [حمض السلفوريك ، الحمض الكبريتي ، حمض الكبريت ، ماء النار ، زيت الزاج].
يعتبر هذا الحمض من أوائل الأحماض التي تم التعرف اليها قديماً، حيث عرفه العرب في القرن الثامن الميلادي، بينما عرفته أوروبا في القرنين الرابع والخامس عشر ، وقد اطلق عليه الكيميائي العربي الذي حضره "جابر بن حيان" بزيت الزاج، وينسب إليه أكتشافه في القرن الثامن الميلادي.
يؤدي حمض الكبريتيك ادوار مهمه في الصناعة حيث انه يدخل في كثير من التفاعلات الكيميائية الصناعية ويدخل بشكل مباشر في إنتاج الكثير من المواد الصناعية والسلع المستخدمة في الحياة اليومية ، ويعتبر مستوى إنتاجه دليلاً على القدرة الصناعية لأي بلد وتعود وفرة استخدامه إلى رخصه وتنوع تأثيره الكيميائي.
على الرغم من إمكانية تحضير هذا الحمض بتركيز يصل الى نسبة 100% إلا أنه يفقد ثالث اكسيد الكبريت SO3 عند درجة الغليان وبالتالي يعطي حمض تركيزه 98.3% ينحل في الماء ناشراً كمية كبيرة من الحرارة، ونتيجة لذلك ينصح بالحذر عند تمديد هذا الحمض (تخفيفه بالماء) ، وذلك بصب الحمض فوق الماء وليس العكس حيث انه شره جداً للماء، لهذا يستخدم في تجفيف الغازات الرطبة، كما ان له القدره على اتلاف المواد العضوية والخلايا الحية لسحبه الماء منها.
يصنف الكيميائيين حمض الكبريتيك بوصفه حمض معدني قوي له القدرة على الذوبان بجميع التراكيز ، ومن الناحية الحيوية بإمكان هذا الحمض ان يحرق الجلد ويهيج النسيج المبطن للأنف والقصبة الهوائية والرئتين ، بالمقابل تحمي معايير الأمان في كثير من البلدان، العاملين في المختبرات الكيميائية والمصانع من التعرض الزائد عن الحد المسموح به - الموضح ضمن بند الآثار البيئية في الأسفل - من حامض الكبريتيك أو لأبخرته المتصاعدة.
الخواص الكيميائية لحمض الكبريتيك:
ان الخواص الكيميائية لحمض الكبريتيك تختلف بحسب تركيزه، فحمض الكبريتيك الممدد بالماء ( المخفف ) يتفاعل بشكل مباشر مع المعادن الواقعة قبل الهيدروجين في "السلسلة الكهروكيميائية" ليعطي كبريتات المعدن ويتحرر الهيدروجين، أما المعادن التي تقع بعد الهيدروجين كالنحاس والفضة مثلاً فلا يتفاعل معها إلا بوجود مؤكسد قوي مثل حمض الآزوت، ولا يتفاعل أطلاقاً مع الذهب والبلاتين.
أما بالنسبة لحمض الكبريتيك ( المركز ) فإنه يتفاعل مع جميع المعادن الواقعة قبل وبعد الهيدروجين في "السلسلة الكهروكيميائية" ليعطي كبريتات المعدن وثنائي أكسيد الكبريت والماء.
كما يتفاعل أيضا مع اللامعادن ليعطي ثنائي أكسيد الكبريت وأكسيد اللامعدن والماء، ويعود السبب في ذلك أن لحمض الكبريتيك المركز والساخن خواص مؤكسدة بحيث انه يتلقى الإلكترونات من العنصر المختزل ( المرجع ) في تفاعل "أكسدة-إرجاع" على النحو التالي:
2H2SO4 + 2e− → (SO4)2− + 2H2O + SO2
الأهمية الاقتصادية لحامض الكبريتيك:
يعتبر حمض الكبريت من المواد الكيميائية الأكثر أهمية نظراً لدخوله في الكثير من الصناعات ، ولأهميته الكبيره هذه فقد تم اعتباره المقياس الاساسي لتقدم ونهضة البلدان والأمم بالاعتماد على مقدار ما تنتجه هذه البلدان من هذا الحمض.
وعلى الرغم من اهمية حمض الكبريت في الصناعة إلا ان له آثار ضارة لا يستهان بها ، تتطلب الحرص التام بكل تأكيد عند استخدامه فهو كما يقال سلاح قوي ذو حدين.
اهم استخدامات حمض الكبريتيك:
الاستخدام الرئيسي لحمض الكبريتيك وبنسبة تصل الى (60% من العالم كله) يكون في "العملية الرطبة" لإنتاج حمض الفوسفوريك H3PO4 ، الذي يستخدم في صناعة الأسمدة الفوسفاتية، وكذلك فوسفات ثلاثي الصوديوم Na3PO4 المستخدم في صناعة المنظفات.
- يعتبر مركب هام لصناعة المطاط والصوابين والمنظفات.
- يساعد في عملية ازالة الاوساخ العالقة.
- يستخدم كمادة مؤكسدة ونازعة للماء.
- يدخل بشكل مباشر في صناعة بطاريات السيارات.
- يدخل في صناعات البلاستيك والكحول والأصباغ ويدخل كذلك في انتاج موادها الخام.
- له دور مهم في صناعات الحديد والنحاس والزجاج.
- يدخل في صناعة المفرقعات والالعاب النارية.
- له دور مهم في عمليات تكرير النفط وصناعة الزيوت.
- يساهم بشكل فعال في حفظ بعض انواع من الأطعمة.
طرق تحضير حمض الكبريتيك:
تم وصف طريقة التحضير التجارية لحمض الكبريتيك في القرن السادس عشر الميلادي.
تعتمد حالياً عملية تحضير وتصنيع حمض الكبريتيك على الكبريت وكذلك على الكبريتات التي تستخدم كمواد أولية، كما تحتاج أيضا إلى النقاوة العالية بسبب النشاط الكميائي الشديد لهذا احامض. ويمكن أن يحضر حامض الكبريتيك إما معملياً أو صناعياً.
ويتم تحضيره صناعياً بإحدى طريقتين:
- طريقة التلامس أو طريقة التماس.
- طريقة غرف الرصاص.
ويكون الحمض الناتج عن طريقة التلامس اكثر نقاوة وتركيز من الحمض الناتج عن طريقة غرف الرصاص.
1 - طريقة التماس:
تم تطوير هذه الطريقة في العام 1831م، وهي الطريقة الصناعية الأكثر انتشاراً حالياً وبتكلفة انتاجية قليلة.
وبالمقارنة مع طريقة غرف الرصاص فإن طريقة التلامس هذه هي الأفضل نظراً لان حمض الكبريتيك الناتج منها يكون اكثر نقاوة.
تشمل هذه العملية الصناعية مراحل مختلفة مرتبة كالتالي :
[ 1 ] : يتم صهر الكبريت وترشيحه من أجل فصل الأجزاء الغير منصهرة، ثم يتم ضخه إلى وحدة خاصة بحرق الكبريت للحصول على ثاني أكسيد الكبريت SO2 ، ثم يتم تمرير هذا الغاز SO2 الناتج مؤخراً على سخان بإستخدام انبوب ساخن ثم إلى مرشح من اجل تنقية الغاز من الشوائب، بعد ذلك يتم نقله إلى برج التحويل لاكسدته مع معدن كالبلاتين مثلاً للحصول على ثالث أكسيد الكبريت SO3 ، ثم يتم امتصاص هذا الغاز الناتج بواسطة الماء وفق المعادلة التالية :
SO3 + H2O ⇌ H2SO4
ويستخدم خماسي أكسيد الفانديوم V2O5 كعامل حفاز لهذه العملية.
[ 2 ] : بعد ذلك يتم اخذ هذا المحلول الناتج إلى وسط برج الأوليوم ، وتؤخذ اجزاء من الحمض الناتج من أسفل هذا البرج إلى مبرد الأوليوم ليصعد جزء منه مرة أخرى إلى أعلى هذا البرج وبالتالي يتم الحصول على حمض الكبريتيك H2SO4 الذي يتجه مباشرة إلى الخزانات.
وبالنسبة إلى تركيز الحمض الناتج فهو يختلف بحسب درجة التبخر.
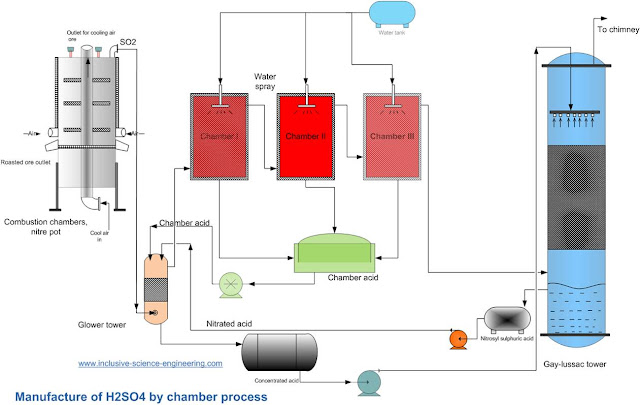
2 - طريقة غرف الرصاص:
وهي طريقة سهلة وقليلة التكلفة، تم تطويرها في إنجلترا في القرن الثامن عشر عبر الصناعي جون روبوك.
تعتمد هذه الطريقة الصناعية على تفاعل ثاني اكسيد الكبريت SO2 مع الماء في وجود ثاني أكسيد النتروجين NO2 لتعطي حمض الكبريتيك H2SO4 وأحادي أكسيد النتروجين NO ثم تتم بعد ذلك أكسدة "أحادي أكسيد النتروجين NO" لانتاج ثاني أكسيد النتروجين NO2 فيتم اعادته كذلك لبرج التفاعل مرة أخرى ليتفاعل مع الماء وثاني أكسيد الكبريت SO2 وبذلك نحصل على حمض الكبريتيك حسب المعادلات التالية:
SO2 + H2O + NO2 → H2SO4 + NO
2NO + O2 → 2NO2
ومن المتعارف عليه في الاوساط الصناعية فإن التحضير عبر هذه الطريقة غير مكلف ولكن بالمقابل فإن الحمض الناتج منها يعتبر ضعيف نسبياً.
وكإقتراح كيميائي يمكن صناعة وتحضير حمض الكبريتيك H2SO4 من ثاني أوكسيد الكبريت SO2 الذي يتم الحصول عليه كناتج ثانوي في عملية تحميص النحاس وبيريت الحديد وغيرهما من خامات الكبريت الأخرى ، وتستخدم عملية التحميص في فصل وتنقية خامات المعادن وذلك من خلال تسخينها في الهواء.
ويمكن في المستقبل لمحطات توليد الكهرباء التي وقودها يأتي عبر احراق الفحم ان تزودنا بشكل أساسي وعملي بحمض الكبريتيك ، حيث يمكن هنا إنتاج هذا الحمض من ثاني أوكسيد الكبريت SO2 الذي ينتج من عملية تنقية الغازات المنطلقة والمتصاعدة خلال احتراق الفحم ، ولكن نظراً لنسبة الشوائب الكبيرة المتواجدة ضمن هذه الغازات، بالتالي يصبح من الصعب تجميع ثاني أكسيد الكبريت SO2 بالطرق المعروفة حالياً ويدرس العلماء بشكل مكثف في ابحاثهم هذه العملية للوصول الى آلية اكثر جدوى وفاعلية للحصول على ثاني أوكسيد الكبريت SO2 بشكل نقي.
ومن المشاكل الاقتصادية لهذه العملية وجود محطات توليد الكهرباء والطاقة في اماكن بعيدة مما يصعب عملية نقل حمض الكبريتيك منها حيث ان هذا الحمض وكما اشرنا سابقاً يعتبر مادة آكلة وحارقة وكذلك فإن النقل من مسافات بعيدة يعمل على رفع تكلفة وقيمة هذا الحمض المنتج.
الآثار البيئية لحمض الكبريتيك:
يعد حامض الكبريتيك احد مكونات الأمطار الحمضية، حيث يتكون عبر أكسدة غاز الأكسجين الجوي لثاني أكسيد الكبريت في وجود الماء "أكسدة حمض الكبريتوز".
ويعتبر "ثاني أكسيد الكبريت" الناتج الأساسي لعمليات حرق الكبريت أو أحد أنواع الوقود الذي يحتوي على الكبريت مثل الفحم والزيت.
ان الأمطار الحمضية الناجمة عن حمض الكبريتيك تؤدي إلى تلف المحاصيل الزراعية، وبالنسبة للإنسان فان الجرعة القاتلة من حمض الكبريتيك تبلغ من ( 4 - 5 سنتمتر مكعب ) وهي التي تؤدي إلى الوفاة بعد "12 - 48 ساعة" من التعاطي وذلك بسبب الصدمة العصبية والدموية الناجمة عن الألم المحرق أو الجفاف نتيجة القيء المتكرر، وقد يؤدي ذلك في بعض الحالات الى تشوه جسم الإنسان.




شكرا على المعلومات
ردحذف