لمعرفة كيفية تحديد تهجين أيون اليود الثلاثي I-3 يجب اولاً وبشكل اساسي تذكر ان I-3 هو أنيون خطي ، يتشكل هذا التركيب الهندسي الخطي من خلال ربط I2 مع ايون -I ، بالتالي سوف يكون الأيون -I هو المانح، وجزيء I2 هو المستقبل، بحيث يتم استيعاب الإلكترونات عادة في المدارات الفارغة.
مبدأياً ان نوع التهجين في أيون اليود الثلاثي I-3 في الأساس هو من نوع (sp3d) ، وإلى التفاصيل...
ما هو تهجين أيون ثلاثي اليود؟
لمعرفة تهجين أيون ثلاثي اليود ، يمكننا استخدام صيغة التهجين البسيطة والتي تُعطى على النحو التالي:
Number of Hybridization = (Valence electron + monovalent + (negative charge) – (positive charge))/2
رتبة التهجين = (إلكترونات التكافؤ + عدد الايونات أحادية التكافؤ + (عدد الشحنات السالبة) - (عدد الشحنات الموجبة)) / 2
إذا نظرنا إلى ذرات اليود في الايون المذكور I-3 سنجد ان:
- هناك سبعة إلكترونات تكافؤ في غلافها الخارجي.
53[I] : [Kr] 4d10 5s2 5p5
- توجد ذرتان تكافؤهما احادي (الغير مركزيتان).
- عند الجمع بين ايون اليود (-I) مع ذرتي اليود الأخرى I2 ، تكتسب الذرة المركزية شحنة سالبة قيمتها 1 ، أي ان فرق عدد الشحنات يساوي 1 .
إذا وضعنا أو استبدلنا القيم وفقاً للصيغة او القانون المذكور سابقا ، سنحصل على ما يلي:
رتبة التهجين = (إلكترونات التكافؤ 7 + عدد الايونات أحادية التكافؤ 2 + عدد الشحنات السالبة 1 ) / 2
=(7+1+2)/2 = 10/2 = 5
اذن رقم التهجين او بالأصح رتبة التهجين يساوي (5) فبالتالي يكون نوع التهجين لليود في I-3 هو (sp3d) حيث انه يتم تحديد نوع التهجين من العدد الناتج كما يلي:
(2=sp)
(3=sp2)
(4=sp3)
(5=sp3d)
(6=sp3d2)
وهكذا...
وبطريقة اخرى مغايرة لما سبق يمكننا أيضاً تحديد نوع التهجين في (I-3) من خلال معرفة عدد الذرات المستقبلة لإلكترونات التكافؤ وكذلك عدد الأزواج الحرة في الذرة المركزية، ثم حساب مجموعها.
وفي حالة أيون ثلاثي اليود (I-3) توجد ثلاثة (3) أزواج حرة للذرة المركزية ، في حين أن عدد الذرات المستقبلة إلكترونات التكافؤ هي ذرتان (2) (ذرتي اليود الغير مركزية) أي التي عن يمين الذرة المركزية فهي ذرة مستقبلة والذرة التي على يسار الذرة المركزية وهي ايضا مستقبلة.
وإذا جمعنا هذه القيم معاً (3 ثلاثة أزواج حرة + 2 ذرتان مركزيتان) نحصل على الرقم الناتج (5) والذي يعني كما اشرنا سابقاً تهجين (sp3d).
ايضاً يجب الانتباه الى ومعرفة ما نوع الهندسة الجزيئية او الشكل الهندسي للمركب المذكور ؟! وما زاوية الربط في أيون ثلاثي اليود (I-3) ؟!
ان الشكل الهندسي الجزيئي للأيون ثلاثي اليود (I-3) هو الشكل الجزيئي (خطي) لماذا؟
والسبب في ان الشكل الهندسي الجزيئي لأيون ثلاثي اليود (I-3) هو الشكل (خطي) كما يلي:
بما أن هناك ثلاث ذرات من اليود ، واحدة من تلك الذرات لديها شحنة سالبة (أي الذرة المركزية) تمتلك هذة الذرة المركزية 3 أزواج حرة من الإلكترونات وترتبط كذلك بذرتي يود اخرتين (مستقبلة للإلكترونات) ، بالتالي سيكون الرقم المعياري الناتج هو (5) لذلك سيحدث تنافر بين ازواج الالكترونات الحرة (الأزواج الحرة الثلاثة) وبالتالي ستتخذ كلاً من الازواج الحرة مواقع مستوية متباعدة عن بعضها بزوايا متساوية ، ثم يكون لدينا ذرتي اليود المتبقيتين سيحدث بينهما تنافر مبتعدتان عن بعضهما البعض بزاوية 180 درجة.
ملخص التهجين:
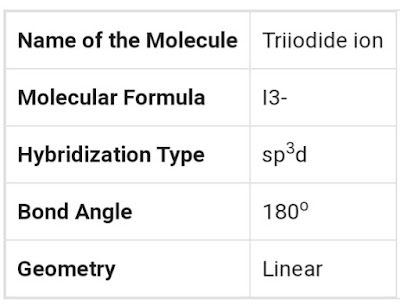
- نوع التهجين الذي حدث لأيون ثلاثي اليود (I-3) هو (sp3d).
- الشكل البنائي (الهندسي) لأيون ثلاثي اليود هو (خطي).
- الزاوية بين الأفلاك المهجنة: 180° .
- الغرض من التهجين: شرح تهجين أيون ثلاثي اليود (I-3).
انظر ايضاً







عزيزي الزائر، اكتب لنا تعليقك على الموضوع..