 عزيزي القارى كما نعلم جميعنا ان كل ما حولنا في هذا الكون البديع عبارة عن تفاعلات كيميائية ، توفر لنا هذه التفاعلات السبيل للعيش والبقاء أو الموت والفناء ، وكل ذلك بالطبع يحدث بأمر الخالق سبحانه وتعالى.
عزيزي القارى كما نعلم جميعنا ان كل ما حولنا في هذا الكون البديع عبارة عن تفاعلات كيميائية ، توفر لنا هذه التفاعلات السبيل للعيش والبقاء أو الموت والفناء ، وكل ذلك بالطبع يحدث بأمر الخالق سبحانه وتعالى.ونعلم ان هذا الكون العظيم مكون بالاساس من عناصر كيميائية ، وهذه العناصر التي تشكل الكون وما يحوية تتواجد إما بشكلها العنصري أو بشكل مركبات ومواد مكونة من إتحاد عنصرين كيميائيين أو أكثر مع بعضهم البعض ، ومع تطور العلوم والتكنولوجيا إزداد الإستخدام البشري بشكل مباشر للعناصر الكيميائية من أجل الانتاج والصناعة والبناء والتقدم والتكنووجيا.
ولكن... على أي اساس يعتمد استخدامنا لهذة العناصر الكيميائية ؟
يعتمد استخدام العنصر الكيميائي في مجال ما على عدة عوامل منها:
1. توفر الصفات الملائمة
هنالك علاقة بين استخدام العنصر وتركيبه الإلكتروني وصفاته ، فالتركيب الإلكتروني يمنح صفات معينة للعنصر، تؤهله لاستخدامات معينة.
فمثلاً يستخدم النحاس في صناعة الأسلاك الكهربائية لأنه موصل جيد للحرارة والكهرباء لاحتوائه على إلكترونات حرة الحركة في تركيبه الإلكتروني، ومن جهة أخرى البوتاسيوم فلز كالنحاس ولكنه لا يستخدم لنفس الغرض على الرغم من احتوائه أيضاً على إلكترونات حرة الحركة لأنه طري ودرجة انصهاره منخفضة ( 63.7 ْ س ) وغير قابل للسحب كالنحاس.
2. توافره
العناصر نادرة الوجود لا يمكن استخدامها في الصناعات التي تتطلب كميات كبيرة منه.
3. كلفة استخراجه
العناصر الثمينة لا يمكن استخدامها في المجالات التي تتطلب استهلاك كميات كبيرة منها. فمثلاً لا يمكن استخدام الذهب في صناعة الأسلاك الكهربائية على الرغم من كونه موصلاً جيداً للكهرباء أو أن يستخدم في صناعة أدوات الطبخ وذلك لكلفته العالية.
يقال أن نابليون بونابرت امبراطور فرنسا كان يتناول طعامه بأدوات من الألومنيوم، وكان ما دون من النبلاء وأفراد حاشيته يتناولون طعامهم بأدوات من الذهب، وذلك بسبب ندرته وكلفة استخراجه العاليتين في ذلك الوقت.
يقال أن نابليون بونابرت امبراطور فرنسا كان يتناول طعامه بأدوات من الألومنيوم، وكان ما دون من النبلاء وأفراد حاشيته يتناولون طعامهم بأدوات من الذهب، وذلك بسبب ندرته وكلفة استخراجه العاليتين في ذلك الوقت.
4.سهولة تحضيره
بعض العناصر الممثلة واستخداماتها
توجد العناصر في الطبيعة بشكل حر أو متحدة مع نفسها أو مع غيرها من العناصر. وهنالك عدة مصادر للعناصر وهي:
1. القشرة الأرضية.
2. البحار.
3. الهواء الجوي.
الجدول الآتي يبين النسب المئوية بالكتلة للعناصر في القشرة الأرضية:
توجد العناصر في الطبيعة بشكل حر أو متحدة مع نفسها أو مع غيرها من العناصر. وهنالك عدة مصادر للعناصر وهي:
1. القشرة الأرضية.
2. البحار.
3. الهواء الجوي.
الجدول الآتي يبين النسب المئوية بالكتلة للعناصر في القشرة الأرضية:
نسبة وجوده %
|
العنصر
|
46.60
|
أكسجين
|
27.72
|
سيليكون
|
8.13
|
ألومنيوم
|
5.00
|
حديد
|
3.63
|
كالسيوم
|
8.92
|
عناصر أخرى
|
طرق استخلاص عناصر من القشرة الأرضية
أ.التحليل الكهربائي
تستخلص بعض العناصر من مركباتها عن طريق إمرار تيار كهربائي خلال محاليل أو مصاهير مركباتها .
مثال : يحضر الصوديوم والكلور بالتحليل الكهربائي لمصهور كلوريد الصوديوم.
يتجه أيون الصوديوم إلى المهبط ويحدث له اختزال بفعل الإلكترونات القادمة من البطارية .
نصف التفاعل / الاختزال
يتجه أيون الكلوريد إلى المصعد ويحدث له تأكسد, وتتحد كل ذرتين منها لتكون جزيئاً من جزيئات الكلور
نصف التفاعل/ التأكسد
والإلكترونات الخارجة من المصعد تعود إلى البطارية مجدداً .
يضرب نصف تفاعل الاختزال في (2) , ويجمع نصفي التفاعل :
يتم الحصول على العناصر بهذه الطريقة من مصاهير أو محاليل المركبات حتى تتحرك الأيونات نحو الأقطاب.
من أهم المعوقات عند تحليل مصاهير المركبات ارتفاع درجات انصهار تلك المواد مما يزيد من كلفة تحضير العنصر ، وقد أمكن الحد من هذه المشكلة بإضافة مواد تؤدي إلى خفض درجات الانصهار.
أمثلة:
ـ يضاف كلوريد الكالسيوم CaCl2 لخفض درجة انصهار كلوريد الصوديوم NaCl والمستخدم في تحضير الصوديوم.
ـ يضاف الكريولايت Na3AlF6 وفلوريد الألومنيوم AlF3 لخفض درجة انصهار الألومينا Al2O3 والمستخدم في تحضير الألومنيوم.
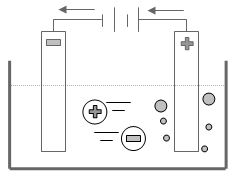
الشكل التالي يمثل خلية داونز Downs Cell وهو الجهاز الذي يستخدم لتحضير الصوديوم في الصناعة من مصهور كلوريد الصوديوم المذاب في كلوريد الكالسيوم لخفض درجة الإنصهار.
الشكل التالي يمثل خلية داونز Downs Cell وهو الجهاز الذي يستخدم لتحضير الصوديوم في الصناعة من مصهور كلوريد الصوديوم المذاب في كلوريد الكالسيوم لخفض درجة الإنصهار.
ب.اختزال خامات العنصر بوساطة عناصر أخرى
يمكن الحصول على عنصر قليل النشاط عن طريق اختزاله بعنصر آخر أكثر نشاطاً .
تذكر سلسلة النشاط:




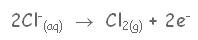
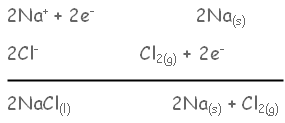


عزيزي الزائر، اكتب لنا تعليقك على الموضوع..