التھجین hybridization
فكرة التھجین في الكیمیاء تعتمد على مزج العدید من الاوربیتالات الذریة المختلفة في اشكالھا وطاقتها للحصول على نسق متشابه من الاوربیتالات ذات الاشكال والطاقات المتشابھة ، وتكون ملائمة للاواصر الكیمیائیة الناتجة من نظریة اصرة التكافؤ (رابطة التكافؤ).تعريف التهجين Hybridization:
يعطى التهجين تفسيراً لطبيعة الأفلاك الذرية وكيفية اتحادها لتكوين الأفلاك الجزيئية وهى عبارة عن عملية تداخل بين أفلاك الذرة الواحدة المتقاربة في الطاقة والتي ينتج عنها افلاك جديدة متساوية في الطاقة والشكل.
تعريف الفلك الجزيئي Molecular orbital:
- يصف الفلك الجزيئي حيزاً من الفراغ الذي تتحرك فيه الإلكترونات ويشمل نواتين أو أكثر كما يتسع لإلكترونين مزدوجين كحد أقصى وتكون طاقة الإلكترون في الفلك الجزيئي الرابط أقل منها في الفلك الذري المستقل.
- تتم عملية التهجين بعد إثارة الذرة - نتيجة لامتصاص طاقة - حيث ينتقل إلكترون من فلك فرعي أقل طاقة إلى فلك فرعي أعلى طاقة.
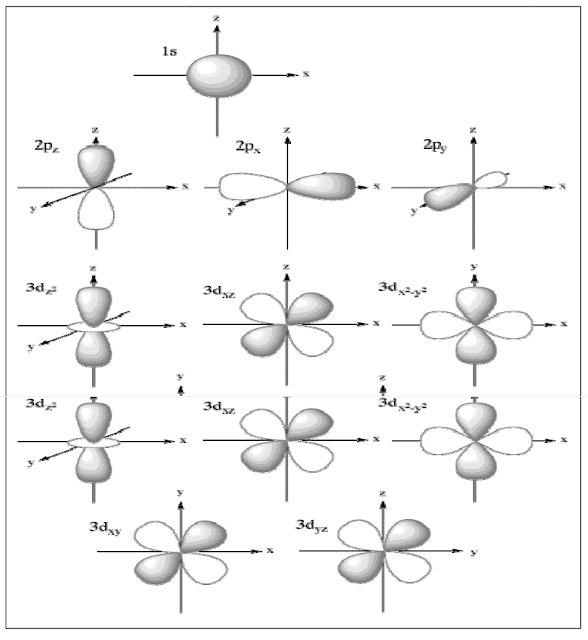
هنا لاحظ اشكال الاوربیتالات الذریة d, p,s في الشكل التالي كیف ھي مختلفة
وفي حالة التھجین تندمج الاشكال لتكون بنسق واحد وكما هو مبین في الشكل ادناه
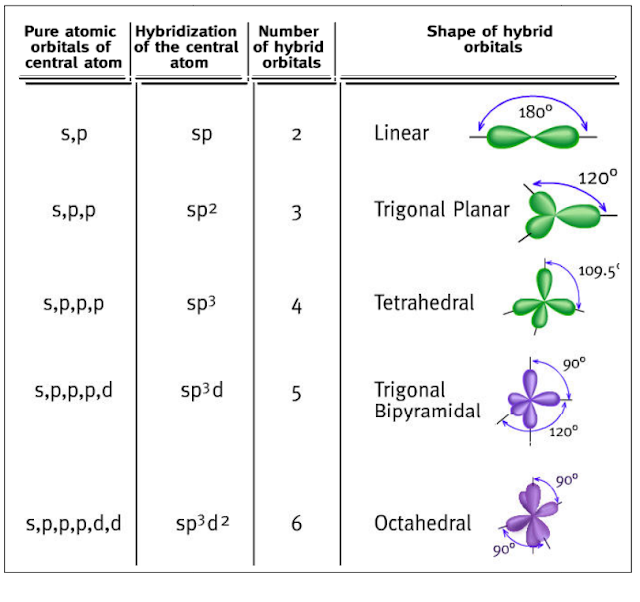
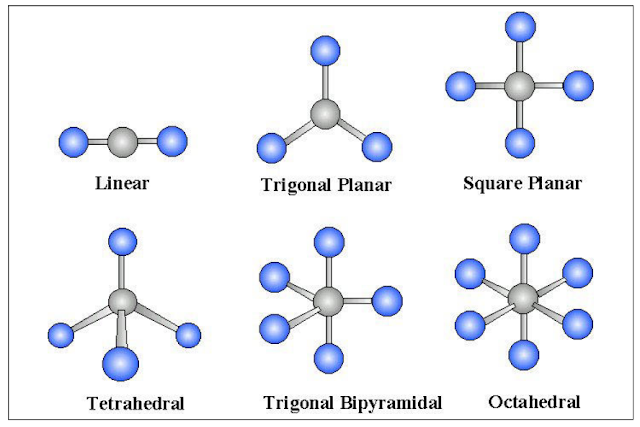
بالنسبة لأشكالھا الھندسیة فتكون كما یلي:
تهجين وبناء جزئ الميثان CH4 - Methane
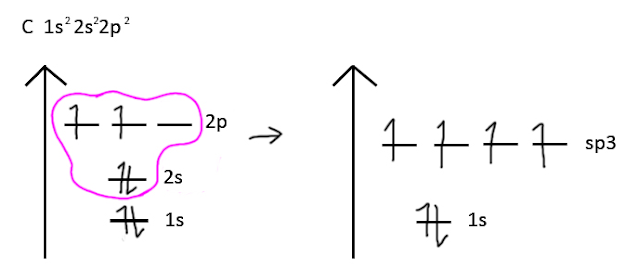
- من المعروف ان الكربون C لديه التوزيع الإلكتروني التالي 1s2 2s2 2p2.
- من خلال التوزيع الإلكتروني لذرة الكربون نرى أنها تمتلك مزدوج إلكتروني في الفلك الفرعي (2s) وإلكترونين مفردين في الفلك الفرعي (2p).
- عند إثارة ذرة الكربون ينتقل إلكترون من الفلك الفرعي (2s) إلى الفلك الفرعي (2p) وبذلك تمتلك ذرة الكربون 4 افلاك نصف ممتلئة ولكنها غير متماثلة في الشكل والطاقة.
- يحدث التهجين بين أفلاك (2s) وأفلاك (2p) في مستوى طاقي أعلى من مستوى طاقة الفلك (2s) وأقل من مستوى طاقة الفلك (2p) فتتكون 4 أفلاك متماثلة في الشكل والطاقة ، وكما تظهر الأدلة المساندة أن المدارين 2s و 2p يتم جمعهما لتشكيل مدارات هجينة ، مما يسمح لجزيء poly-atomic بأن يكون له 25٪ مدار s و٪ 75 p وبالتالي فإننا نطلق على الميثان جزيء sp3-hybridized.
- اذاً هنا نكون قد توصلنا الى ان الأفلاك المهجنة تسمى أفلاك (sp3) لأنها نتجت من تهجين فلك (s) مع ثلاثة أفلاك (p).
- تتنافر الأفلاك المهجنة فيما بينها حتى تصل زوايا الربط (Bond angle) إلى 109.5 درجة.
- يتم التداخل بين الأفلاك المهجنة وفلك (1s) لأربع ذرات هيدروجين فتتكون 4 روابط تساهمية أحادية من النوع سيجما (Sigma bond) وبذلك يتكون جزئ الميثان.
- عدد الروابط المتكونة في جزي الميثان أربعة روابط كلها من النوع سيجما.
- اذاً هنا نكون قد توصلنا الى ان الأفلاك المهجنة تسمى أفلاك (sp3) لأنها نتجت من تهجين فلك (s) مع ثلاثة أفلاك (p).
- تتنافر الأفلاك المهجنة فيما بينها حتى تصل زوايا الربط (Bond angle) إلى 109.5 درجة.
- يتم التداخل بين الأفلاك المهجنة وفلك (1s) لأربع ذرات هيدروجين فتتكون 4 روابط تساهمية أحادية من النوع سيجما (Sigma bond) وبذلك يتكون جزئ الميثان.
- عدد الروابط المتكونة في جزي الميثان أربعة روابط كلها من النوع سيجما.
- ومن خلال دراسة تهجين جزئ الميثان نستنتج أن الشكل الهندسي له هو هرم رباعي الأوجه tetrahedral.
أخيراً نطرح بعض الملاحظات حول تهجين جزيء الميثان:
- الرابطة سيجما : (σ) (Sigma bond) هي رابطة تنشأ من التداخل الأفقي للأفلاك أي تكونت على خط واحد.
- لا ترتبط ذرات الهيدروجين مع ذرة الكربون المثارة لأن الأفلاك تكون متعامدة بزوايا 90 درجة وكذلك وجود نوعين من الأفلاك المختلفة في الشكل والطاقة (s,p).
كان لدينا في هذة المقالة مثال لتهجين من نوع sp3 وهو جزيء الميثان ، إنظر أيضاً:
أخيراً نطرح بعض الملاحظات حول تهجين جزيء الميثان:
- الرابطة سيجما : (σ) (Sigma bond) هي رابطة تنشأ من التداخل الأفقي للأفلاك أي تكونت على خط واحد.
- لا ترتبط ذرات الهيدروجين مع ذرة الكربون المثارة لأن الأفلاك تكون متعامدة بزوايا 90 درجة وكذلك وجود نوعين من الأفلاك المختلفة في الشكل والطاقة (s,p).
كان لدينا في هذة المقالة مثال لتهجين من نوع sp3 وهو جزيء الميثان ، إنظر أيضاً:







مرحبا
RépondreSupprimerتهجين اليود في I 3_ بالتفصيل اذا امكن
تهجين اليود في I3- :
Supprimerلمعرفة كيفية تحديد تهجين I3- ، يجب اولا وبشكل اساسي تذكر ان I3− هو أنيون خطي. يتشكل هذا التركيب الهندسي الخطي من خلال ربط I2 مع ايون I− ، بالتالي سوف يكون الأيون I− هو المانح، وجزيء I2 هو المستقبل، بحيث يتم استيعاب الإلكترونات عادة في المدارات الفارغة.
ان تهجين I3- في الأساس هو من نوع (sp3d) ... وإلى التفاصيل..
ما هو تهجين أيون ثلاثي اليود؟
لمعرفة تهجين أيون ثلاثي اليود ، يمكننا استخدام صيغة التهجين البسيطة والتي تُعطى على النحو التالي:
Number of Hybridization = (Valence electron + monovalent + (negative charge) – (positive charge))/2
رتبة التهجين = (إلكترونات التكافؤ + عدد الايونات أحادية التكافؤ + (عدد الشحنات السالبة) - (عدد الشحنات الموجبة)) / 2
إذا نظرنا إلى ذرات اليود في الايون المذكور سنجد ان:
١- هناك سبعة إلكترونات تكافؤ في غلافها الخارجي.
53[I] : [Kr] 4d10 5s2 5p5
٢- توجد ذرتان تكافؤهما احادي (الغير مركزيتان).
٣- عند الجمع بين ايون اليود (I-) مع ذرتي اليود الأخرى I2 ، تكتسب الذرة المركزية شحنة سالبة قيمتها 1 ، أي ان فرق عدد الشحنات يساوي 1 .
إذا وضعنا أو استبدلنا القيم وفقًا للصيغة او القانون المذكور سابقا ، سنحصل على ما يلي:
رتبة التهجين = (إلكترونات التكافؤ 7 + عدد الايونات أحادية التكافؤ 2 + عدد الشحنات السالبة 1 ) / 2
=(7+1+2)/2 = 10/2 = 5
اذن رقم التهجين او بالأصح رتبة التهجين يساوي 5، فبالتالي يكون نوع التهجين لليود في I3- هو (sp3d) ، حيث انه يتم تحديد نوع التهجين من العدد الناتج كما يلي:
(2=sp)
(3=sp2)
(4=sp3)
(5=sp3d)
(6=sp3d2)
وهكذا...
وبطريقة اخرى مغايرة لما سبق يمكننا أيضاً تحديد نوع التهجين في (I3-) من خلال معرفة عدد الذرات المستقبلة لإلكترونات التكافؤ وكذلك عدد الأزواج الحرة في الذرة المركزية، ثم حساب مجموعها.
في هذه حالة الانيون (I3-) توجد ثلاثة (3) أزواج حرة، في حين أن عدد الذرات المستقبلة إلكترونات التكافؤ هي ذرتان (2) (ذرتي اليود الغير مركزية) أي التي عن يمين الذرة المركزية فهي ذرة مستقبلة والذرة التي على يسار الذرة المركزية وهي ايضا مستقبلة.
إذا جمعنا هذه القيم معاً ، نحصل على الرقم الناتج (5) والذي يعني كما اشرنا سابقاً تهجين (sp3d).
ايضاً يجب الانتباه ومعرفة ما نوع الهندسة الجزيئية او الشكل الهندسي للمركب المذكور ؟! وما زاوية الربط في (I3-) ؟!
ان الشكل الهندسي الجزيئي للانيون ثلاثي اليود (I3-) هو الشكل الجزيئي (خطي) .
وبما أن هناك ثلاث ذرات من اليود ، واحدة من تلك الذرات لديها شحنة سالبة (أي الذرة المركزية) تمتلك هذة الذرة المركزية 3 أزواج حرة من الإلكترونات وترتبط كذلك بذرتي يود اخرتين، بالتالي سيكون الرقم المعياري الناتج هو (5) ، سيحدث تنافر ازواج الالكترونات الحرة (الأزواج الحرة الثلاثة) وبالتالي ستتخذ كلاً من الازواج الحرة مواقع مستوية متباعدة عن بعضها بزوايا متساوية ، ثم يكون لدينا ذرتي اليود المتبقيتين سيحدث بينهما تنافر مبتعدتان عن بعضهما البعض بزاوية 180 درجة.
هل ممكن مساعدتي في تكوين بحث عن التهجين مع المصادر انا طالبة جامعية
RépondreSupprimerنعم ممكن ، ومن دواعي سرورنا تقديم المساعدة الممكنة للطلبة.
Supprimer- ما هي النقاط التي لم تتمكني من التوصل اليها لعمل البحث المطلوب؟
- آلية عمل البحوث الجامعية بشكل عام تكون كما يلي:
* ملخص (يكون في بداية البحث ، ويتم عمله عند الانتهاء من عمل البحث)
* المقدمة (يتم البدء في كتابتها بشكل عام ثم التخصيص الى الموضوع الرئيسي للبحث بشكل تدريجي ، وهي تعتبر بمثابة نبذة تاريخية عن الموضوع ثم التدرج الى التعريف بما ستقوم به وما الذي ستقدمة من خلال البحث)
*المناقشة (على سبيل المثال ذكر انواع التهجين الكيميائي ومعلومات عن كل نوع ، وكيفية التفريق بينها بالاعتماد على مراجع ومصادر حقيقية)
* الجزء العملي (كيفية الحصول معمليا على المركب التي تم التركيز عليها في مناقشة تهجينه)
* النتائج المترتبة على الجزء العملي والتي تثبت ان الناتج فعلا هو ذلك المركب الذي تم تهجينه بالاعتماد على بعض الآليات على سبيل المثال بالاعتماد على نتائج IR, HNMR...وغيرها)
* الخاتمة (بيان اهم النتائج التي تم عرضها في البحث وبماذا يمكن ان تستخدم او بما ستفيد)
- المعلومات السابقة لآلية عمل البحث هي لأبحاث الدرجة العلمية ، وبالنسبة للأبحاث البسيطة التي يقوم بها الطلبة في بعض المراحل الدراسية تكون ابسط من ذلك.
- في حالة تم دمج المناقشة والنتائج في نفس الجزء البحثي يتم البدء بعرض الجزء العملي بعد المقدمة ثم بعد ذلك المناقشة والنتائج.
انا اقوم بعمل بحث عن التهجين... وبحثت كثيرا ووجدت مواضيع لكن لم اجد مصادر لها فقط شرح وانا احتاج مصادر
Supprimerاتمنى ان يصلني رابط عن موضوع التهجين يحتوي ع مصادر.....
Supprimerشكرا على الرد السريع......
Supprimerلم اعد احتاج الى رابط.....
تقرير عن التهجين والشكل الهندسي والتاصر في الجزيئات الخطيه
RépondreSupprimerانظر التهجين الكيميائي من نوع sp
Supprimerhttps://chemitechnical.blogspot.com/2020/01/sp-hybridization.html?m=1
ارد رابط التهجين وبي مصادر محتاجه دا يطلبون منا تقارير واريد رابط عن التهجين محتاجه
RépondreSupprimerهلوو عيني...
Supprimerانا أيضا طالبه مثلك وكنت محتاجه رابط حتى ادخل عليه واعمل تقرير لكن اعتمدت على نفسي ووجدت الرابط بنفسي. لذلك انا اعلم ماهو شعورك لذلك ادخلي على هذا الرابط وستجدين ماتريدين ان شاء الله...
https://en.m.wikipedia.org/wiki/Orbital_hybridisation
https://en.m.wikipedia.org/wiki/Orbital_hybridisation
RépondreSupprimerhttps://en.m.wikipedia.org/wiki/Orbital_hybridisation
Supprimerواذا لم تستطيعي الدخول اليه انشري لي وانا اجاوبكي...... واشرح لكي بالتفصيل كيف تدخلين...
Supprimerمجموعة من الكتب والابحاث والدراسات التي يتم اعتمادها كمرجعيات لأبحاث التهجين...
RépondreSupprimerملاحظة:
اسفل كل كتاب مرجع او دراسة او بحث، يوجد الرابط المباشر لتحميل ذلك المرجع والاستفادة منه ، بعض هذه المراجع وخصوصا الكتب لا يمكن الحصول عليها بسهولة كونها غير متوفرة مجانا ، وقد وفرناها لكم بشكل مجاني وبرابط تحميل مباشر لكي تستفيدوا منها لوفرة المعلومات القيمة فيها.
1- Clayden, Greeves, Warren and Wothers. ORGANIC CHEMISTRY. Oxford University Press Inc., New York (2001). Structure of molecules p.81-110.
https://drive.google.com/u/0/uc?id=1zvX2YUzwsCipyRgAHNj4bbCj9sjSj7Kc&export=download
2- ZVONIMIR B. MAKSIC, SYMMETRY HYBRIDIZATION AND BONDING IN MOLECULES. Comp. & Maths. with Appls. Vol. 12B, Nos. 3/4, pp. 697-723, 1986.
https://core.ac.uk/reader/82505494
3- الكيمياء العضوية. أ.د. اياد سعدي حميد. جامعة تكريت - كلية العلوم. ص16-22 .
https://csci.tu.edu.iq/cd/images/%D8%A7%D9%84%D9%83%D9%8A%D9%85%D9%8A%D8%A7%D8%A1_%D8%A7%D9%84%D8%B9%D8%B6%D9%88%D9%8A%D8%A9_%D8%A3.%D8%AF._%D8%A3%D9%8A%D8%A7%D8%AF_%D8%B3%D8%B9%D8%AF%D9%8A_%D8%AD%D9%85%D9%8A%D8%AF.pdf
4- مبادئ الكيمياء العامة. د.محي الدين البكوش، د.نوري بسيبسو، د.ياسر حورية، د.نبيل شيخ قروش. شركة ألجا للنشر العلمي، (2003). بنية المركب الكيميائي (نظرية الروابط) ص169-182.
https://books-library.online/files/books-library.online-11112242Fd3Z4.pdf
5- McMurray, J. (1995). Chemistry Annotated Instructors Edition (4th ed.). Prentice Hall. p. 272. ISBN 978-0-131-40221-8
http://shorturl.at/pxy69
6- Pauling, L. (1970). General Chemistry (pp. 161-163).
https://upload.wikimedia.org/wikipedia/commons/0/08/GeneralChemistry.pdf
7- Grushow, A. (2011). Is It Time To Retire the Hybrid Atomic Orbital?. J. Chem. Educ., 88(7), 860-862. http://dx.doi.org/10.1021/ed100155c
https://dacemirror.sci-hub.tw/journal-article/65e777391aafed954c3b66f7c6fa8499/grushow2011.pdf
8- Chang, Raymond. "Hybridization of Atomic Orbitals." Physical Chemistry for the Biosciences. Sansalito, CA: University Science, 2005. 450-55. Print.
9- Petrucci, Ralph H. "Hybridization of Atomic Orbitals." General Chemistry: Principles and Modern Applications. 9th ed. Upper Saddle River, NJ: Pearson/Prentice Hall, 2007. Print.
10- Pauling, L. (1931), "The nature of the chemical bond. Application of results obtained from the quantum mechanics and from a theory of paramagnetic susceptibility to the structure of molecules", Journal of the American Chemical Society, 53 (4): 1367–1400, doi:10.1021/ja01355a027
https://twin.sci-hub.tw/6981/487a38fd818a1d99df3355f92d3ab516/pauling1931.pdf
مع خالص تمنياتنا لكم بالتوفيق
ممكن شرح عن تهجين sp3d بالتفصيل مع المصادر
RépondreSupprimerتم اعداد هذه المقالة لشرح تهجين sp3d مع اضافة المصادر
Supprimerتجد المقالة على هذا الرابط
https://chemitechnical.blogspot.com/2020/07/chemical-hybridization-sp3d.html
ممكن اعرف شكل غلاف اسم هذا الكتاب لكي احمله......
RépondreSupprimeratkins _physical _ chemistry _ 9 _ by.pdf
https://books.google.com/books?id=BV6cAQAAQBAJ&printsec=frontcover&dq=atkins+physical+_+chemistry+_+9+_+by.pdf&hl=ar&sa=X&ved=0ahUKEwjCgKSi4b3qAhWqA2MBHQqgAJwQ6AEIIzAA#v=onepage&q&f=false
Supprimerشكراً على سرعة الرد.....
Supprimer?Why is iodine purple in color احتاج إلى إجابة ع هذا السؤال
RépondreSupprimerفي الواقع يوصف عنصر "اليود" أنه يحتوي على لون بنفسجي ، ويعود سبب رؤيتنا لهذا اللون البنفسجي الى أن لليود خاصية تميزه عن غيره من العناصر الاخرى ، حيث ان اليود يعكس الطول الموجي للضوء المرئي بين مدى ( 4000 إلى 4460 انجستروم ) ، لذلك فإن هذا المدى المحدد من الطول الموجي يؤدي الى رؤيتنا اللون البنفسجي المنعكس من اليود.
SupprimerElemental iodine is actually described to have a violet colour, not purple.
The reason for its violet colour is because Iodine has a characteristic property to reflect that wavelength of visible light (between the range of 4000 to 4460 Angstrom).
Due to the reflection of that wavelength, it can form an image in our eye which is violet in colour.
تهجين Na2co3 من يا نوع؟
RépondreSupprimerشكراً جزيلا على هذا الشرح الرائع
RépondreSupprimer