ماهي الكواشف الكيميائية؟ وما الفائدة منها؟
دعونا اعزائي المتابعين نتعرف الى اهم المعلومات عن الكواشف الكيميائية في هذة المقالة الموجزة..
تعريفها:
الكاشف الكيميائي أو المادة المتفاعلة - بشكل عام - عبارة عن مادة أو مركب يتمّ إضافتها للنظام من أجل إحداث تفاعل كيميائي (مادة متفاعلة) أو تُضاف لاختبار حدوث التفاعل. وعلى الرغم من أن مصطلحات متفاعل وكاشف غالباً ماتستخدم بالتبادل ، فالمتفاعل " مادة تُستهلك في سياق التفاعل الكيميائي ".
المذيبات والمواد الحفازة تتضمن في التفاعل ، إلا أنها عادة لا يُشار لها بالمتفاعلات لأنها لا تتغير.
المذيبات والمواد الحفازة تتضمن في التفاعل ، إلا أنها عادة لا يُشار لها بالمتفاعلات لأنها لا تتغير.
أما في الكيمياء العضوية:
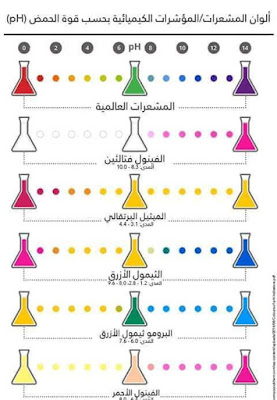
تعرف الكواشف بأنها محاليل لمواد عضوية ملونة تضاف الى التفاعل لمعرفة نقطة نهاية التفاعل وكذلك نقطة بدايتة وذلك بتغيرلون المحلول ولا تدخل الكواشف المضافة في التفاعل وانما يتغير لونها بتغير الوسط فمثلاً الفينول فثالين :احمر في الوسط القاعدي عديم اللون في الوسط الحمضي.
 |
| كاشف الفينول فثالين |
جدول الكواشف الكيميائية :
وكما ذكرنا سابقاً بأنه يمكن استخدام الكواشف الكيميائية العضوية لإختبار حدوث تفاعل كيميائي بين المواد المضافة الى التفاعل، ويوجد منها عدة أنواع تم ترتيبها في جدول يسمى جدول الكواشف الكيميائية، سنذكر بعضاً منها:
كاشف غرينيارد
العديد من المشتقات العضوية من المغنيسيوم والتي تمثل بالصيغة العامة RMgX حيث تمثل R الهيدروكربونات مثل CH3 وC2H5 وC6H5 في حين تمثل X ذرات هالوجين التي تمثل المجموعة السابعة في الجدول الدوري مثل الكلور والبروم واليود، سميت بهذا الاسم نسبة إلى مكتشفها الفرنسي فيكتور غرينيارد، ويتم تحضير هذه الكواشف بتفاعل الهالوجين مع المغنيسيوم في جو من النتروجين، نظرًا لأن الكاشف يتفاعل بشدة مع الأكسجين والرطوبة، تختلف المركبات الهالوجينية بشكل كبير في تفاعلها مع المغنيسيوم مثلًا تتفاعل هاليدات الألكيل بسرعة في حين تتفاعل كلوريد الأريل ببطء شديد.
كاشف تولنز
هو كاشف كيميائي يستخدم لتحديد وجود الألدهيد والألدهيد العطري، يتكون هذا الكاشف من محلول الأمونيا ونترات الفضة، تسمى بهذا الاسم نسبة إلى مكتشفها بيرهارد تولينز، الاختبار الإيجابي لهذا الكاشف في جدول الكواشف الكيميائية أنه يشير إلى وجود الفضة حيث تتشكل مرآة فضية مميزة على السطح الداخلي التفاعل، هذا الكاشف لا توجد له صيغة كيميائية.
كاشف فنتون
هو عبارة عن تفاعل بيروكسيد الهيدروجين ومحفز الحديد، يستخدم بهدف تقليل مستويات الملوثات العضوية من خلال الأكسدة الكيميائية لانتاج الهيدروكسيل، هذا الكاشف يسمح بإزالة المواد العضوية المكلورة والمواد الملوثة العضوية المماثلة بأمان.
كاشف كولنز
مزيج من أكسيد الكروم مع بيريدين في ثنائي كلورو ميثان، صيغته الكيميائية C10H10CrN2O3، يستخدم لأكسدة الكحول الأولي بشكل انتقائي إلى الألدهيد.
كاشف فهلنغ
يتكون هذا الكاشف المدرج في جدول الكواشف الكيميائية من مزيج من كبريتات النحاس وهو أزرق اللون وتارتريك الصوديوم البوتاسيوم، يستخدم هذا الكاشف كيميائي للتمييز بين الكربوهيدرات القابلة للذوبان في الماء والكيتون، ويستخدم لتقليل السكريات المختزلة وغير المختزلة، العيب في هذا الكاشف أنه لا يمكن التمييز بين البنزالدهيد والأسيتون.
ماهو الفرق بين المحفزات والكواشف؟
بعد أن تطرقنا لذكر بعض أنواع الكواشف الكيميائية وما يميزها وأهم خصائصها ، لابد لنا من معرفة ماهو الفرق بين المحفزات والكواشف :تختلف المحفزات عن جدول الكواشف الكيميائية حيث تعمل المحفزات على تغيير معدل التفاعل أي أنه يزيد أو ينقص ولكنها لا تستهلك وتعاود الظهور بعد انتهاء التفاعل على عكس الكاشف الذي يستهلك خلال التفاعل، على الرغم من أن المحفز يسرع التفاعل إلا أنه لا يستهلك خلال التفاعل أما الكاشف فيضاف بهدف اختبار حدوث التفاعل وعليه فإنه يُستهلك اثناء التفاعل ولا يعاود الظهور بعد إنتهاء التفاعل بشكلة الأول كما تمت إضافتة بينما المحفز يعمل على إحداث تغيير في معدل التفاعل ولا يتم إستهلاكة فيعاود الظهور بعد إنتهاء التفاعل.
طريقة تحضير اهم الكواشف الكيميائية
- طريقة تحضير كاشف محلول اليود الكحولي :1) يذاب (6جم) من اليود في (500 مل ) كحول ايثيلي تركيزه 95%
2) يذاب (30 جم ) كلوريد الزئبقيك في (500مل) كحول ايثيلي تركيزة 95%
3) يضاف 1 الى 2 ويخلط جيدا ويوضع في عبوة محكمة الاغلاق
- طريقة تحضير محلول اليود :
يذاب( 20 جم) من يوديد البوتاسيوم في( 30 مل) ماء مقطر ثم يضاف( 7و12 )من اليود النقي ويكمل بالماء المقطر الى لتر مع التحريك
- طريقة تحضير ماء الجير:
يشبع الماء بهيدروكسيد الكالسيوم ثم يرشح ويحفظ في زجاجات محكمة الغطاء
- طريقة تحضير ماء البروم:
ضع( 11 مل) من البروم مع لتر من الماء المقطر
- طريقة تحضير كاشف فهلنج:
محلول فهلنج أ : يذاب 34جم من كبريتات النحاس في 500 مل ماء مقطر
محلول فهلنج ب : يذاب 173 جم من ملح روشيل "طرطرات صوديوم بوتاسيوم" مع 52 جم هيدروكسيد صوديوم في 500 مل ماء مقطر
ملاحظة / في غياب ملح روشيل فإن محلول الطرطرات يستبدل بالاتي : 121 جم من هيدروكسيد الصوديوم و 39.1 جم حمض طرطريك مذاب في 400 مل ماء مقطر ثم يستكمل المحلول الى 500 مل
- طريقة تحضير كاشف ومحلول النشاء :
يخلط 2 جم من النشاء مع قليل من الماء البارد ونحركة حتى نحصل على عجينة رخوة، نضيف 150 مل ماء مغلي ونستمر في الغليان لمدة (5-10) يترك المحلول ليبرد ثم نفصل المحلول الرائق
طريقة تحضير كواشف معايرات التعادل وكواشف الكيمياء غير العضوية
- طريقة تحضير كاشف ودليل الفينولفثالين ph.ph:يضاف 2 جم من الفينولفثالين الى 600مل كحول ايثيلى ويكمل بالماء المقطر الى لتر
- طريقة تحضير كاشف ودليل الميثيل البرتقالي:
يذاب 1 جم من الميثيل البرتقالي في قليل من الكحول الايثيلي ثم يكمل الى لتر بالكحول المخفف بالماء المقطر ( بنسبة 1:1)
- طريقة تحضير كاشف ودليل الميثيل الاحمر:
يذاب 1جم من الميثيل الاحمر في لتر من الماء الساخن أو يذاب 1جم منه في 600 كحول ايثيلي ويكمل الى لتر بالماء المقطر
- طريقة تحضير كاشف البوراكس :
اضف( 5 جم) من تترا بورات الصوديوم"البوراكس" الى لتر من الماء المقطر
- طريقة تحضير كاشف كربونات الصوديوم :
يذاب ( 106 جم ) منه في لتر ماء مقطر
- طريقة تحضير كاشف بيكربونات الصوديوم :
يذاب ( 286 جم ) منه في لتر ماء مقطر
- طريقة تحضير كاشف محلول نسلر :
1) يذاب 50 جم من يوديد البوتاسيوم في 50 مل ماء مقطر
2) يضاف بالتدريج محلول مشبع من كلوريد الزئبقيك ( 60 جم/ لتر ماء مقطر) مع الاستمرار في التقليب حتى بتكون راسب واضح
3) يضاف 400 مل فقط من محلول هيدروكسيد كالسيوم المحضر باضا فة( 248 جم) من هبدروكسيد الكالسيوم الى 500مل ماء مقطر
4) يكمل المحلول الى لتر بالماء المقطر ويوضع في زجاجة قاتمة اللون ويترك لمدة يوم قبل الاستخدام
كواشف الكيمياء العضوية
- طريقة تحضير كاشف الفا نافثول:
يضاف ( 20 جم ) من الفا نافثول الى لتر من الكحول الايثيلي 90%
- طريقة تحضير كاشف بيتا نافثول :
يضاف( 10 جم) بيتا نافثول الى لتر من محلول هيدروكسيد الصوديوم 20%
- طريقة تحضير كاشف دينجز
كاشف دينجز 1 : يضاف (20 مل) من حمض الكبريتيك بحرص الى (100 مل) ماء ثم يذاب فيه(5 جم) من أكسيد الزئبقيك الاحمركاشف دينجز 2 : يذاب ( 20 جم) من برمنجنات البوتاسيوم في لتر ماء مقطر
- كاشف ثنائي ميثيل جليكوزيم : يضاف ( 12جم) منه الى لتر كحول ايثيلي 95%
- كاشف ثنائي فينيل امين : يضاف 1 جم من داي فينيل امين الى 100 مل حمض كبريتيك مركز
- طريقة تحضير كاشف بارا فويد :
يذاب 33 جم من خلات النحاس في 500مل من حمض الخليك 1%
- طريقة تحضير كاشف بندكت :
1) يذاب 10 جم من سترات الصوديوم مع( 8 جم) كربونات صوديوم في 50 مل ماء مقطر ساخن2) يذاب ( 1 جم) من كبريتات النحاس في( 10 مل) ماء مقطر
3) يضاق ب الى أ بالتدريج مع التحريك واذا لم يكن المحلول رائقا يرشح
- طريقة تحضير كاشف برمنجنات البوتاسيوم:
يذاب 9.6 منه في لتر من الماء المقطر ويرشح
- طريقة تحضير كاشف يوديد البوتاسيوم :
يذاب (166جم ) منه في لتر ماء مقطر
- طريقة تحضير كاشف الريزور سينول :
يذاب 8 جم منه في 400 جم من حمض الكبريتيك المخفف 10%
- طريقة تحضير كاشف السلوانوف :
يضاف (100 مل) من حمض الهيدروكلوريك المخفف 10% الى ) 900مل ) ماء مقطر ثم يضاف( 0.5 جم) من الريزور سينول
- طريقة تحضير كاشف نترات الفضة :
يذاب( 107 جم) من نترات الفضة في لتر ماء مقطر
- طريقة تحضير كاشف نترات الفضة النشادرية :
يذاب 50 جم من نترات الفضة في 500 مل ماء مقطر ثم يضاف هيروكسيد الامونبوم المركز نقطة نقطة حتى يصبح المحلول رائقا
- طريقة تحضير كاشف نيترو بروسيد الصوديوم :
يذاب 107 جم من نيترو بروسيد الصوديوم في لتر من الماء المقطر
- طريقة تحضير كاشف حديدي سيانيد البوتاسيوم :
يضاف( 52جم) منه الى ( 500 مل ) ماء مقطر
- طريقة تحضير كاشف حديدو سيانيد البوتاسيوم :
يضاف (550 جم ) منه الى (500 مل ) ماء مقطر
- طريقة تحضير كاشف كربونات الامونيوم :
يذاب ( 80 جم ) منه في ( 150 مل ) من هيدروكسيد الامونيوم المركز ثم يضاف ( 860 مل ) ماء مقطر ويحكم اغلاق العبوة
- طريقة تحضير كاشف كبريتات الامونيوم :
يذاب ( 132 جم ) منه في لتر ماء مقطر
- طريقة تحضير كاشف اكسالات الامونيوم :
يذاب ( 35 جم ) منه في لتر ماء مقطر
- طريقة تحضير كاشف ثيو سيانات الامونيوم :
يذاب ( 76 جم ) منه في لتر ماء مقطر
- طريقة تحضير كاشف موليبيدات الامونيوم :
1) يضاف 40 مل من هيدروكسيد الامونيوم الى 60 مل ماءمقطر2) يضاف (45 جم )من موليبيدات الامونيوم
3) يضاف ( 250مل ) من حمض النيتريك المركز
4) يضاف ( 500 مل ) ماء مع الاستمرار في التقليب
5) يكمل المحلول الى لتر بالماء المقطر
6) يترك لمدة يوم ثم يستخدم المحلول الرائق
- طريقة تحضير كاشف كلوريد الباريوم :
يذاب ( 132 جم ) منه في لتر ماء مقطر
- طريقة تحضير كاشف كلوريد الحديديك :
يذاب ( 135 جم ) منه في [لتر ماء مقطر يحوي 30 مل حمض الهيدروكلوريك]
- طريقة تحضير كاشف كوبلتي نتريت الصوديوم :
يذاب ( 17 جم ) منه في ( 250 مل ) من الماء المقطر ثم يضاف ( 15 مل ) من حمض الخليك الثلجي ثم يرج
المحلول ويخفف بالماء الى ( 250 مل ) ويترك ساعة ثم يرشح ( ثابت لعدة اسابيع )
المحلول ويخفف بالماء الى ( 250 مل ) ويترك ساعة ثم يرشح ( ثابت لعدة اسابيع )
- طريقة تحضير كاشف خلات الصوديوم :
يذاب ( 408 جم ) منه في لتر ماء مقطر
- طريقة تحضير كاشف خلات الرصاص :
يذاب ( 95 جم ) منه في لتر ماء مقطر
- طريقة تحضير كاشف كلوريد الزئبقيك :
يذاب ( 27 جم ) منه في لتر من الماء المقطر
- طريقة تحضير كاشف المغنيسيا " أكسيد الماغنيسيوم " :
1- اذب ( 50 جم ) من كبريتات او كلوريد الماغنيسيوم في قليل من الماء2- اذب ( 70 جم )من كلوريد الامونيوم في قليل من الماء
3-اضف أ و ب الى (300 مل ) من هيدروكسيد الامونيوم
4- اكمل الى لتر بالماء المقطر ويترك عدة ساعات ويستخدم
- طريقة تحضير كاشف كبريتات المغنيسيوم :
يذاب ( 623 جم ) منه في لتر ماء مقطر
- طريقة تحضير كاشف كرومات البوتاسيوم :
يذاب ( 196 جم ) منه في لتر ماء مقطر
- طريقة تحضير كاشف ثاني كرومات البوتاسيوم :
يذاب ( 49 جم ) منه في لتر ماء مقطر
- طريقة تحضير كاشف كلوريد الكالسيوم :
يذاب ( 55 جم ) منه في لتر ماء مقطر
- طريقة تحضير كبريتات الكالسيوم :
يذاب ( 3 جم ) منه في لتر ماء مقطر ويترك ساعة ويرشح
المراجع:
1- "Chemistry", en.wikipedia.org, Retrieved 7-8-2019. Edited.
2- "Reagent Definition and Examples", www.thoughtco.com, Retrieved 6-8-2019. Edited.
3- "Grignard reagent", www.britannica.com, Retrieved 6-8-2019. Edited.
4- "What is tollen's reagent?", www.quora.com, Retrieved 7-8-2019. Edited.
5- "How to Make Fenton's Reagent", sciencing.com, Retrieved 7-8-2019. Edited.
6- "What is Colin's reagent?", www.quora.com, Retrieved 7-8-2019. Edited.
7- "Fehling's solution ", www.wikiwand.com, Retrieved 7-8-2019. Edited.
8- " What is the difference between catalyst and reagent in chemical reaction?", www.quora.com, Retrieved 7-8-2019. Edited.



اخي بالتوفيق لك انت مبدع وهذا يكلف الكثير من الجهد لي مدونه تتحدث عن الكيمياء shareyfriends.blogspot.com
ReplyDeleteنتمنى للجميع الفائده
نتمنى لكم التوفيق ، نشر العلم والمعرفة رسالة نبيلة
Deleteشكرا
ReplyDelete